A teoria da ligação de valência (VB) é uma teoria da ligação química que explica a química vínculo Entre dois átomos. Como a teoria do orbital molecular (MO), ela explica a ligação usando princípios da mecânica quântica. De acordo com a teoria da ligação de valência, a ligação é causada pela sobreposição de átomos atômicos orbitais. Os dois átomos compartilham o elétron não emparelhado um do outro para formar um orbital preenchido para formar um orbital híbrido e se unem. Sigma e ligações pi fazem parte da teoria dos laços de valência.
Principais tópicos: Valence Bond (VB) Theory
- A teoria da ligação de valência ou teoria VB é uma teoria baseada na mecânica quântica que explica como a ligação química funciona.
- Na teoria das ligações de valência, os orbitais atômicos de átomos individuais são combinados para formar ligações químicas.
- A outra grande teoria da ligação química é a teoria orbital molecular ou a teoria MO.
- A teoria da ligação de valência é usada para explicar como ligações químicas covalentes se formam entre várias moléculas.
Teoria
A teoria da ligação de valência prevê a formação de ligações covalentes entre átomos quando eles têm orbitais atômicos de valência meio cheios, cada um contendo um único elétron não emparelhado. Esses orbitais atômicos se sobrepõem, de modo que os elétrons têm a maior probabilidade de estar dentro da região de ligação. Ambos os átomos compartilham os elétrons não pareados para formar orbitais fracamente acoplados.
Os dois orbitais atômicos não precisam ser iguais um ao outro. Por exemplo, as ligações sigma e pi podem se sobrepor. As ligações sigma se formam quando os dois elétrons compartilhados têm orbitais que se sobrepõem frente a frente. Em contraste, as ligações pi se formam quando os orbitais se sobrepõem, mas são paralelos um ao outro.
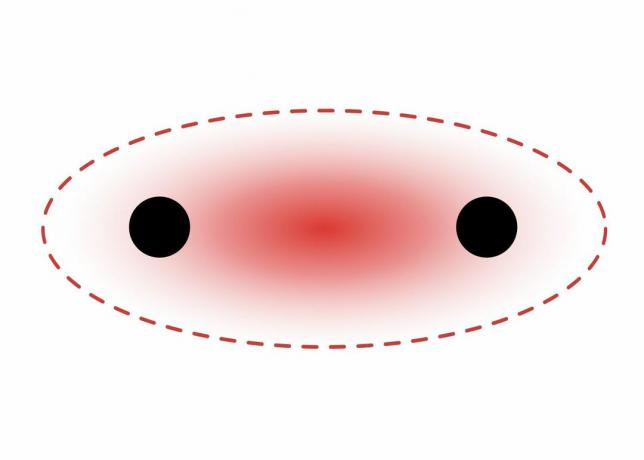
As ligações sigma se formam entre elétrons de dois orbitais s porque a forma orbital é esférica. Ligações simples contêm uma ligação sigma. Ligações duplas contêm uma ligação sigma e uma ligação pi. Ligações triplas contêm uma ligação sigma e duas ligações pi. Quando ligações químicas se formam entre átomos, os orbitais atômicos podem ser híbridos de ligações sigma e pi.
A teoria ajuda a explicar a formação de vínculos nos casos em que Estrutura de Lewis não pode descrever o comportamento real. Nesse caso, várias estruturas de ligação de valência podem ser usadas para descrever uma única restrição de Lewis.
História
A teoria dos laços de valência parte das estruturas de Lewis. G.N. Lewis propôs essas estruturas em 1916, com base na idéia de que dois elétrons de ligação compartilhados formavam ligações químicas. A mecânica quântica foi aplicada para descrever as propriedades de ligação na teoria de Heitler-Londres de 1927. Esta teoria descreveu a formação de ligações químicas entre átomos de hidrogênio na molécula H2 usando a equação de onda de Schrödinger para mesclar as funções de onda dos dois átomos de hidrogênio. Em 1928, Linus Pauling combinou a idéia de ligação de pares de Lewis com a teoria de Heitler-Londres para propor a teoria de vínculos de valência. A teoria da ligação de valência foi desenvolvida para descrever ressonância e hibridação orbital. Em 1931, Pauling publicou um artigo sobre a teoria do vínculo de valência intitulado "Sobre a natureza do vínculo químico". Os primeiros programas de computador usados para descrever a ligação química usada a teoria orbital molecular, mas desde a década de 1980, os princípios da teoria da ligação de valência se tornaram programável. Hoje, as versões modernas dessas teorias são competitivas entre si em termos de descrição precisa do comportamento real.
Usos
A teoria do vínculo de valência geralmente pode explicar como ligações covalentes Formato. o diatômico molécula de flúor, F2, é um exemplo. Os átomos de flúor formam ligações covalentes únicas entre si. A ligação F-F resulta da sobreposição pz orbitais, cada um contendo um único elétron não emparelhado. Uma situação semelhante ocorre no hidrogênio, H2, mas os comprimentos e a força da ligação são diferentes entre H2 e F2 moléculas. Uma ligação covalente se forma entre hidrogênio e flúor em ácido fluorídrico, HF. Essa ligação se forma a partir da sobreposição do hidrogênio 1s orbital e o flúor 2pz orbital, cada um com um elétron não emparelhado. Na HF, os átomos de hidrogênio e flúor compartilham esses elétrons em uma ligação covalente.
Fontes
- Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "A estrutura eletrônica da molécula de benzeno". Natureza. 323 (6090): 699. doi:10.1038 / 323699a0
- Messmer, Richard P.; Schultz, Peter A. (1987). "A estrutura eletrônica da molécula de benzeno". Natureza. 329 (6139): 492. doi:10.1038 / 329492a0
- Murrell, J. N..; Kettle, S.F.A.; Tedder, J.M. (1985). A ligação química (2ª ed.). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Estrutura eletrônica da molécula de benzeno". Natureza. 325 (6103): 396. doi:10.1038 / 325396d0
- Shaik, Sason S.; Phillipe C. Hiberty (2008). Um Guia do Químico da Teoria de Valence Bond. Nova Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.